Online first
Bieżący numer
Archiwum
O czasopiśmie
Polityka etyki publikacyjnej
System antyplagiatowy
Instrukcje dla Autorów
Instrukcje dla Recenzentów
Rada Redakcyjna
Komitet Redakcyjny
Recenzenci
Wszyscy recenzenci
2025
2024
2023
2022
2021
2020
2019
2018
2017
2016
Kontakt
Bazy indeksacyjne
Klauzula przetwarzania danych osobowych (RODO)
PRACA ORYGINALNA
Zmiany w stężeniu markerów stanu zapalnego po rehabilitacji kardiologicznej pacjentów leczonych angioplastyką wieńcową z powodu zawału serca
1
Department of Radioligands, Department of Pharmacobiology, Faculty of Pharmacy, Jagiellonian University Medical College, Kraków, Poland
2
Chair of Clinical Rehabilitation, University School of Physical Education, Kraków, Poland
Autor do korespondencji
Agata Konstancja Pietrzycka
Zakład Radioligandów, Katedra Farmakobiologii, Wydział Farmaceutyczny Collegium Medicum Uniwersytetu Jagiellońskiego, Kraków, Medyczna 9, 30-688, Kraków, Polska
Zakład Radioligandów, Katedra Farmakobiologii, Wydział Farmaceutyczny Collegium Medicum Uniwersytetu Jagiellońskiego, Kraków, Medyczna 9, 30-688, Kraków, Polska
Med Og Nauk Zdr. 2025;31(4):273-280
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wprowadzenie i cel:
Przezskórna angioplastyka wieńcowa, przywracająca przepływ krwi i zwiększająca dopływ tlenu po zawale, może generować stres oksydacyjny i apoptozę, objawiające się uszkodzeniem reperfuzyjnym mięśnia sercowego. Na reakcje między krwią a komórkami śródbłonka mogą wpływać: kwas moczowy i cytokiny prozapalne oraz wielonienasycone kwasy tłuszczowe. Celem pracy była ocena stężeń kwasu moczowego (UA), cytokiny prozapalnej (TNF-α), stopnia utlenienia białek (AOPP) oraz kwasów tłuszczowych: α-linolenowego (ALA) i arachidonowego (ARA) w błonach erytrocytów przed i po 8 tygodniach rehabilitacji kardiologicznej.
Materiał i metody:
Grupa badana (MI) składała się z 26 pacjentów po zawale mięśnia sercowego, w wieku 57,4 ± 5,2 lat. Grupę kontrolną (CTRL) stanowiło 24 mężczyzn w wieku 55,8 ± 7,0 lat, niepalących, w przypadku których wywiad nie ujawnił zawału mięśnia sercowego. TNF-α oznaczono testem ELISA, AOPP mierzono spektrofotometrycznie metodą Witko-Sarsat, a kwasy tłuszczowe ALA i ARA oznaczono metodą chromatografii gazowej.
Wyniki:
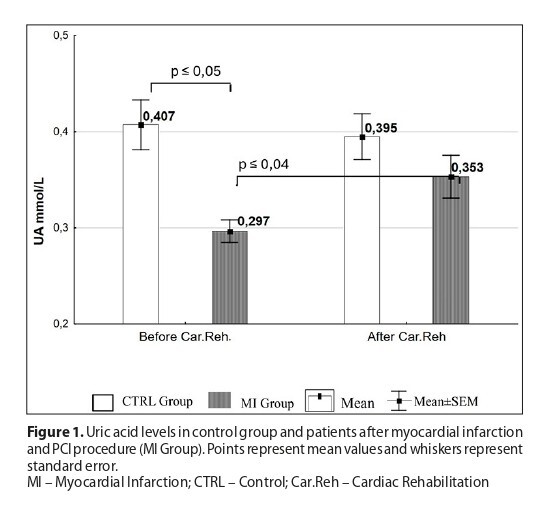
Po rehabilitacji kardiologicznej w grupie MI stwierdzono istotnie wyższe stężenie UA, AOPP oraz TNF-α niż w osoczu kontrolnym (UA: 0,29 mmol/L vs 0,35 mmol/L; AOPP: 52,44 μmol/L vs 55,21 μmol/L; TNF-α: 9,45 pg/mL vs 11,36 pg/mL). Zaobserwowano również, że w grupie MI procentowa zawartość kwasu ALA w błonach erytrocytów zmniejszyła się (z 4,20% do 1,67%), a ARA zwiększyła (z 3,67% do 6,71%).
Wnioski:
Umiarkowane ćwiczenia kardiologiczne zmniejszały poziom markerów procesów zapalnych w grupie kontrolnej, natomiast efektu takiego nie odnotowano w grupie MI. Uzyskane wyniki mogą mieć korzystne znaczenie dla ograniczania procesów zapalnych oraz uszkodzeń reperfuzyjnych mięśnia sercowego. W celu lepszego kontrolowania tych procesów warto rozważyć wzbogacenie codziennej diety pacjentów leczonych angioplastyką wieńcową z powodu zawału serca o kwasy tłuszczowe omega-3 i przeciwutleniacze.
Przezskórna angioplastyka wieńcowa, przywracająca przepływ krwi i zwiększająca dopływ tlenu po zawale, może generować stres oksydacyjny i apoptozę, objawiające się uszkodzeniem reperfuzyjnym mięśnia sercowego. Na reakcje między krwią a komórkami śródbłonka mogą wpływać: kwas moczowy i cytokiny prozapalne oraz wielonienasycone kwasy tłuszczowe. Celem pracy była ocena stężeń kwasu moczowego (UA), cytokiny prozapalnej (TNF-α), stopnia utlenienia białek (AOPP) oraz kwasów tłuszczowych: α-linolenowego (ALA) i arachidonowego (ARA) w błonach erytrocytów przed i po 8 tygodniach rehabilitacji kardiologicznej.
Materiał i metody:
Grupa badana (MI) składała się z 26 pacjentów po zawale mięśnia sercowego, w wieku 57,4 ± 5,2 lat. Grupę kontrolną (CTRL) stanowiło 24 mężczyzn w wieku 55,8 ± 7,0 lat, niepalących, w przypadku których wywiad nie ujawnił zawału mięśnia sercowego. TNF-α oznaczono testem ELISA, AOPP mierzono spektrofotometrycznie metodą Witko-Sarsat, a kwasy tłuszczowe ALA i ARA oznaczono metodą chromatografii gazowej.
Wyniki:
Po rehabilitacji kardiologicznej w grupie MI stwierdzono istotnie wyższe stężenie UA, AOPP oraz TNF-α niż w osoczu kontrolnym (UA: 0,29 mmol/L vs 0,35 mmol/L; AOPP: 52,44 μmol/L vs 55,21 μmol/L; TNF-α: 9,45 pg/mL vs 11,36 pg/mL). Zaobserwowano również, że w grupie MI procentowa zawartość kwasu ALA w błonach erytrocytów zmniejszyła się (z 4,20% do 1,67%), a ARA zwiększyła (z 3,67% do 6,71%).
Wnioski:
Umiarkowane ćwiczenia kardiologiczne zmniejszały poziom markerów procesów zapalnych w grupie kontrolnej, natomiast efektu takiego nie odnotowano w grupie MI. Uzyskane wyniki mogą mieć korzystne znaczenie dla ograniczania procesów zapalnych oraz uszkodzeń reperfuzyjnych mięśnia sercowego. W celu lepszego kontrolowania tych procesów warto rozważyć wzbogacenie codziennej diety pacjentów leczonych angioplastyką wieńcową z powodu zawału serca o kwasy tłuszczowe omega-3 i przeciwutleniacze.
Introduction and objective:
Percutaneous coronary angioplasty, which restores blood flow and increases oxygen delivery after myocardial infarction, can generate oxidative stress and apoptosis, leading to reperfusion injury. The interactions between blood and endothelial cells can be influenced by uric acid, pro-inflammatory cytokines, and polyunsaturated fatty acids. The aim of the study was to assess the concentrations of uric acid (UA), pro-inflammatory cytokine (TNF-α), advanced protein oxidation products (AOPP), and the fatty acids α-linolenic acid (ALA) and arachidonic acid (ARA) in erythrocyte membranes, before and after 8 weeks of cardiac rehabilitation.
Material and methods:
The study group (MI) consisted of 26 patients after myocardial infarction, aged 57.4 ± 5.2 years. The control group (CTRL) consisted of 24 men aged 55.8 ± 7.0 years, non-smokers, and without a history of myocardial infarction. TNF-α was measured by ELISA, AOPP was measured spectrophotometrically using the Witko-Sarsat method; fatty acids ALA and ARA were determined by gas chromatography
Results:
After cardiac rehabilitation, the MI group had significantly higher plasma concentrations of UA, AOPP, and TNF-α than in the control group (UA: 0.29 mmol/L vs. 0.35 mmol/L; AOPP: 52.44 μmol/L vs. 55.21 μmol/L; TNF-α: 9.45 pg/mL vs. 11.36 pg/mL). In the MI group, the percentage of ALA in erythrocyte membranes decreased (from 4.20% to 1.67%), while ARA increased (from 3.67% to 6.71%).
Conclusions:
Moderate cardiac exercise reduced markers of inflammation in the control group, but not in the MI group. The results may exert beneficial effects in controlling inflammatory processes and reperfusion injury of the myocardium. To manage these processes, enrichment the daily diet with omega-3 fatty acids and antioxidants should be considered.
Percutaneous coronary angioplasty, which restores blood flow and increases oxygen delivery after myocardial infarction, can generate oxidative stress and apoptosis, leading to reperfusion injury. The interactions between blood and endothelial cells can be influenced by uric acid, pro-inflammatory cytokines, and polyunsaturated fatty acids. The aim of the study was to assess the concentrations of uric acid (UA), pro-inflammatory cytokine (TNF-α), advanced protein oxidation products (AOPP), and the fatty acids α-linolenic acid (ALA) and arachidonic acid (ARA) in erythrocyte membranes, before and after 8 weeks of cardiac rehabilitation.
Material and methods:
The study group (MI) consisted of 26 patients after myocardial infarction, aged 57.4 ± 5.2 years. The control group (CTRL) consisted of 24 men aged 55.8 ± 7.0 years, non-smokers, and without a history of myocardial infarction. TNF-α was measured by ELISA, AOPP was measured spectrophotometrically using the Witko-Sarsat method; fatty acids ALA and ARA were determined by gas chromatography
Results:
After cardiac rehabilitation, the MI group had significantly higher plasma concentrations of UA, AOPP, and TNF-α than in the control group (UA: 0.29 mmol/L vs. 0.35 mmol/L; AOPP: 52.44 μmol/L vs. 55.21 μmol/L; TNF-α: 9.45 pg/mL vs. 11.36 pg/mL). In the MI group, the percentage of ALA in erythrocyte membranes decreased (from 4.20% to 1.67%), while ARA increased (from 3.67% to 6.71%).
Conclusions:
Moderate cardiac exercise reduced markers of inflammation in the control group, but not in the MI group. The results may exert beneficial effects in controlling inflammatory processes and reperfusion injury of the myocardium. To manage these processes, enrichment the daily diet with omega-3 fatty acids and antioxidants should be considered.
Pietrzycka AK, Gdula-Argasińska J, Pabisiak AM, Bromboszcz J. Alterations in inflammatory markers following cardiac rehabilitation in
patients undergoing coronary angioplasty due to myocardial infarction. Med Og Nauk Zdr. 2025;31(4):273–280. doi:10.26444/monz/212752
REFERENCJE (25)
1.
Mužáková V, Meloun M, Jindrová A, et al. The effect of fatty acids in red blood cell membranes on the dynamics of inflammatory markers following the coronary stent implantation. J Pharm Biomed Anal. 2019;166:310–325. https://doi.org/10.1016/j.jpba....
2.
Tucker B, Vaidya K, Cochran BJ, et al. Inflammation during
Percutaneous Coronary Intervention-Prognostic Value, Mechanisms
and Therapeutic Targets. Cells. 2021;10(6):1391–1418. https://doi.
org/10.3390/cells10061391
3.
Zheng Y, Chen Z, Yang J, et al. The Role of Hyperuricemia in
Cardiac Diseases: Evidence, Controversies, and Therapeutic
Strategies. Biomolecules. 2024;14(7):753–769. https://doi.org/10.3390/
biom14070753
4.
Zhang S, Yan F, Luan F, Chai Y, Li N, Wang YW, Chen ZL, Xu DQ,
Tang YP. The pathological mechanisms and potential therapeutic
drugs for myocardial ischemia reperfusion injury. Phytomedicine.
2024;129:1556–1549. https://doi.org/10.1016/j.phym...
5.
Ganguly R, Hasanally D, Stamenkovic A, et al. Alpha linolenic acid decreases apoptosis and oxidized phospholipids in cardiomyocytes during ischemia/reperfusion. Mol Cell Biochem. 2018;437(1–2):163–175. s11010-017-3104-z.
6.
Russell JS, Griffith TA, Naghipour S, et al. Dietary α-Linolenic
Acid Counters Cardioprotective Dysfunction in Diabetic Mice:
Unconventional PUFA Protection. Nutrients; 2020;12(9):2679–2710.
https://doi.org/10.3390/nu1209...
7.
O'Mahoney LL, Churm R, Stavropoulos-Kalinoglou A, et al.
Associations Between Erythrocyte Membrane Fatty Acid Compositions
and Biomarkers of Vascular Health in Adults With Type 1 Diabetes
With and Without Insulin Resistance: A Cross-Sectional Analysis. Can
J Diabetes. 2022;46(2):111–117. https://doi.org/10.1016/j.jcjd...
8.
Wu C, Chen X, Yang L, et al. Exercise Mediates Noncoding RNAs
in Cardiovascular Diseases: Pathophysiological Roles and Clinical
Application. Expert Rev Mol Med. 2024;27:e2;1–11. https://doi.org/10.1017/erm.20...
9.
El Assar M, Álvarez-Bustos A, Sosa P, et al. Effect of Physical Activity/ Exercise on Oxidative Stress and Inflammation in Muscle and Vascular Aging. Int J Mol Sci. 2022;23(15):8713–8749. https://doi.org/10.3390/ijms23....
10.
Witko-Sarsat V, Friedlander M, Capeillère-Blandin C, et al. Advanced oxidation protein products as a novel marker of oxidative stress in uremia. Kidney Int. 1996;49(5):1304–1313. https://doi.org/10.1038/ki.199....
11.
Spiroski D, Andjić M, Stojanović OI, et al. Very short/short-term benefit of inpatient/outpatient cardiac rehabilitation programs after coronary artery bypass grafting surgery. Clin Cardiol. 2017;40(5):281–286.
https://doi.org/10.1002/clc.22....
12.
Mandurino-Mirizzi A, Cornara S, Somaschini A, et al. Elevated serum uric acid is associated with a greater inflammatory response and with short- and long-term mortality in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Nutr Metab Cardiovasc Dis. 2021;31(2):608–614. https://doi.org/10.1016/j.nume....
13.
Li N, Li Y, Cui L, et al. Uric acid and risk of incident heart failure in individuals with cardiovascular disease. Nutr Metab Cardiovasc Dis. 2024;34(12):2763–2770. https://doi.org/10.1016/j.nume....
14.
Wu H, Dai R, Wang M, et al. Uric acid promotes myocardial infarction injury via activating pyrin domain-containing 3 inflammasome and reactive oxygen species/transient receptor potential melastatin 2/ Ca2+pathway. BMC Cardiovasc Disord. 2023;23(1):10–22. https://doi.org/10.1186/s12872....
15.
Żurawska-Płaksej E, Płaczkowska S, Pawlik-Sobecka L, et al. Parameters of Oxidative and Inflammatory Status in a Three-Month Observation of Patients with Acute Myocardial Infarction Undergoing Coronary Angioplasty-A Preliminary Study. Medicina (Kaunas). 2019;55(9):585. https://doi.org/10.3390/medici....
16.
Miao J, Du T. The relationship between levels of tumor necrosis factoralpha, interleukin-6, and C-reactive protein in the serum of elderly and acute myocardial infarction. Cell Mol Biol (Noisy-le-grand). 2024;70(4):95–99. https://doi.org/10.14715/cmb/2....
17.
Cheng X, Yang Z. Effect of resistance training on inflammatory markers in middle-aged and older adults: A meta-analysis. Arch Gerontol Geriatr. 2024;126;105536. https://doi.org/10.1016/j.arch....
18.
Malandish A, Karimi A, Naderi M, et al. Impacts of Exercise
Interventions on Inflammatory Markers and Vascular Adhesion
Molecules in Patients With Heart Failure: A Meta-analysis of RCTs.
CJC Open. 2023;5(6):429–453 https://doi.org/10.1016/j.cjco...
19.
Shanmugam G, Narasimhan M, Sakthivel R, Kumar R R, Davidson
C, Palaniappan S, Claycomb WW, Hoidal JR, Darley-Usmar VM,
Rajasekaran NS. A biphasic effect of TNF-α in regulation of the Keap1/
Nrf2 pathway in cardiomyocytes. Redox Biol. 2016;9:77–89.
https://doi.org/10.1016/j.redo...
20.
Alanova P, Alan L, Opletalova B, et al. HIF-1α limits myocardial infarction by promoting mitophagy in mouse hearts adapted to chronic hypoxia. Acta Physiol (Oxf). 2024;240(9):e14202. https://doi.org/10.1111/apha.1....
21.
Naryzhnaya NV, Maslov LN, Derkachev IA, et al. The effect of an adaptation to hypoxia on cardiac tolerance to ischemia/reperfusion. J Biomed Res. 2022;37(4);230–254. https://doi.org/10.7555/JBR.36....
22.
Sala-Vila A, Fleming J, Kris-Etherton P, Ros E. Impact of α-Linolenic Acid, the Vegetable ω-3 Fatty Acid, on Cardiovascular Disease and Cognition. Adv Nutr. 2022;13(5):1584–1602. https://doi.org/10.1093/advanc....
23.
Lázaro I, Rueda F, Cediel G, et al. Circulating Omega-3 Fatty Acids and Incident Adverse Events in Patients With Acute Myocardial Infarction. J Am Coll Cardiol. 2020;76(18):2089–2097. https://doi.org/10.1016/j.jacc....
24.
Shuo Wang, Chaxian Liu, Chengxin Gong, et al. Alpha linolenic acid intake alleviates myocardial ischemia/reperfusion injury via the P2X7R/NF-κB signaling pathway. Journal of Functional Foods; 2018;49:1–11. https://doi.org/10.1016/j.jff..... (https://www.sciencedirect.com/...).
25.
Ribeiro APF, de Lima Rodrigues M, Loureiro C, et al. Physical exercise alone or combined with omega-3 modulates apical periodontitis induced in rats. Sci Rep. 2025;15(1):8760–8771. http://doi.org./10.1038/s41598....
Przetwarzamy dane osobowe zbierane podczas odwiedzania serwisu. Realizacja funkcji pozyskiwania informacji o użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje oraz zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka). Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług, zapewnienia wygodnego korzystania ze strony oraz w celu monitorowania ruchu zgodnie z Polityką prywatności. Dane są także zbierane i przetwarzane przez narzędzie Google Analytics (więcej).
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.